真快,2022年也结束了。
这一年里,博药不断尝试以专业人才和优质内容,向全国观众直播展示一线医药产业知识,从根本上缓解行业长期学习资源分配不均,三四线或偏远城市难以真正触达前沿知识的痛点。
事实上,博药也成功做到了将需求与内容的完美匹配,2022年,博药直播间共举办了22场线上直播课,共计2700+分钟。
内容涵盖了工艺落地、政策解读等10数个专业话题的探讨。
今天,博药内容组制作了2022博药直播间年度大盘点,和大家一起温故知新,展望来年。文末更有精彩活动同步进行,精彩直播课PPT资料包一键获取。
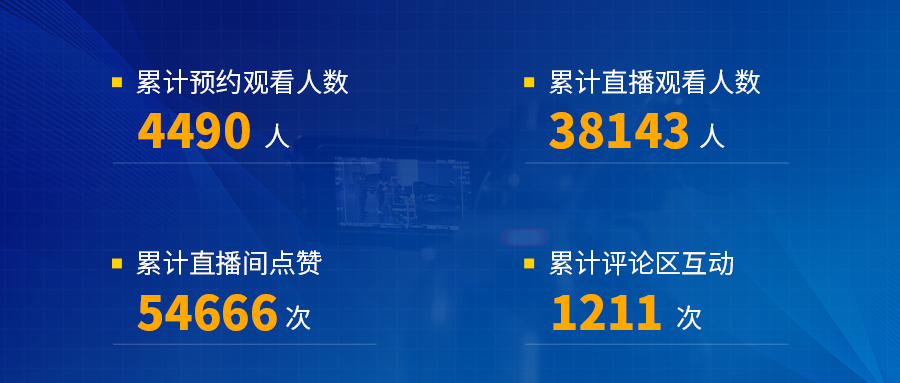
小容量注射剂过量灌装研究
5 /12
一直以来,注射剂因其特殊性,在其研发阶段都应充分考虑分装量的大小对临床疗效及安全性的影响。自2019年10月15日,国家药品监督管理局发布化学药品注射剂仿制药一致性评价征求意见稿以来,关于注射剂“过量灌装”的研究,就有诸多内容需要尤其注意。例如参比制剂存在过量灌装,仿制药的过量灌装宜与参比制剂保持一致,如不一致需提供合理性论证等等。
2022年5月12日,博腾股份制剂事业部研发高级经理喻義先生分享了主题名为“小容量注射剂过量灌装研究”的直播课堂。

从什么是“过量灌装”、为什么要进行“过量灌装”、“过量灌装”相关的法规要求、过量灌装”的研究与“过量灌装”的五大方面讨论,以真实案例为基础为直播间观众全面剖析了“过量灌注”的意义所在,并着重强调了过量灌装研究资料的准备中的时间节点选择,以期探索出符合现行技术及法规要求的研究思路,帮助更多行业人士接触心中疑惑。
持续性新工艺验证在GMP中间体
和API中的应用和案例分享
6 /16

持续性工艺验证(CPV,Continuous Process Verification)作为验证生命周期的第3阶段,是对已经完成产品的验证状态是否受控的持续确认活动。虽然持续性工艺验证的概念在《FDA工艺验证指南(2011年)》就已经被提出,但对国内CDMO企业和传统药企,相较于工艺验证而言,持续性工艺验证还是一个比较新的概念。
2022年6月16日,博腾博腾长寿工厂技术部副总监王维先生以《持续性工艺验证在GMP中间体和API生产中的应用和案例分享》为题,针对其法规要求,持续性工艺验证怎么做进行了最真实的案例分析。
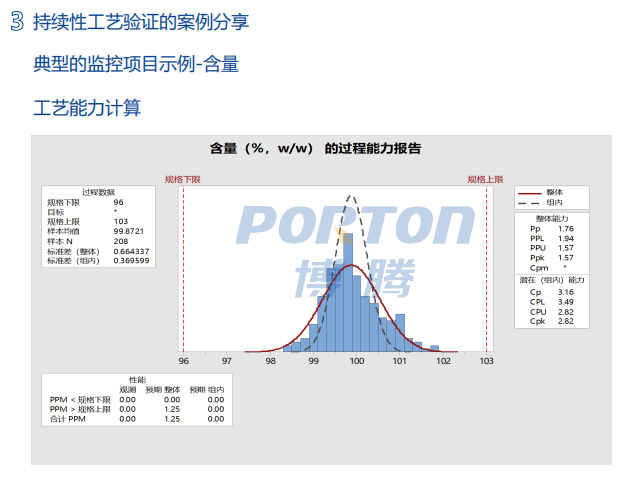
并总结到,持续性工艺验证可以另企业及时发现异常的数据趋势,提高对产品的工艺认知 以及减少产品失败概率,是企业生产运营过程中尤为重要的内容,应该引起重点关注。
《药品共线生产质量管理指南》解读
7 /20

2021年11月12日,为指导和规范药品共线生产,NMPA 核查中心组织研究起草并发布了《药品共线生产质量管理指南(征求意见稿)》。博腾股份清洁SME 赵成刚先生针对《意见稿》内容进行了详细解读,对药品共线生产中存在的风险进行管理,对共线生产过程中存在的诸多问题进行了深度剖析。
赵成刚先生指出,目前共线生产存在问题首先体现在对风险认知不足,即对风险管理没有认识,过分流于形式;对现场管理松懈,存在违反 GMP 的缺陷较多。其次是缺乏专业的设计,即设施、厂房布局不科学,设备原理不支持共线;气流分布污染风险严重。最后则是过度依赖验证,用验证结论替代必要的质量管理和质量控制措施,但验证的科学性和合理性存疑。
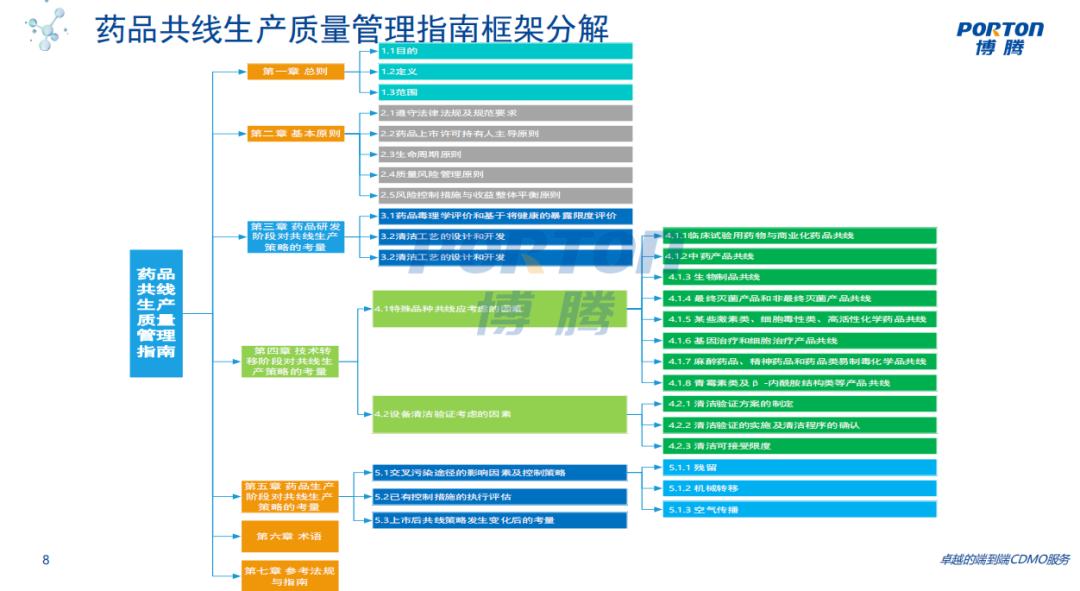
《指南》则分为七个章节,详细的为持有人和药品生产企业提供了参考,特别是药品研发阶段对共线生产策略的考量,强调目前而言,企业对于产品技术转移更为熟悉,但在药品研发阶段忽视共线生产策略,因此造成对于研发样品基本特性数据缺乏。明确药品研发阶段应充分考察研发样品的药理、毒理和理化性质,评估研发样品的危害。
工业4.0拥抱数智化,
制药企业自动化解决方案之DCS应用
8 /10

数字化、信息化转型可谓是近几年所有行业中最炙手可热的话题之一,制药业也是如此。工业4.0时代,大数据、云计算、人工智能等技术飞速发展,数字化的浪潮正向医药行业的每一个角落渗透,数字化转型也成为相关企业在新的市场环境下脱颖而出、寻求高质量发展的必然选择。
博腾股份数据创新部智能生产研究专家谢远其先生针对制药企业为什么要引入自动化系统?总结了其工作经验与心得体会,进行了一系列自动化DCS系统应用经典案例分享。

其强调过程要尤为注意的六大要点工作,一者是自动化是为工艺服务的,在做自动化之前一定要吃透工艺流程;其二,伤其十指不如断其一指,在资金有限不能够做到整场自动化的情况下,应该优先考虑重点工艺流程的全自动化;其三,在CDMO行业里,Batch层级phase尽量下,这样灵活可控;其四,专业人才需要培养,懂工艺又懂自控,懂自控又懂IT的专业技术人员目前十分缺乏;其五,业务数据治疗和应用,需要Batch给业务数据直接打标签;最后,设备可靠性支持,需要考虑设备、工程安装和日常维护等因素,都会影响到系统的稳定性。
谢远其先生最后总结道,自动化生产与研究在制药行业发展势不可挡,赋能制药行业与国际接轨,可以很大程度上助力企业完成智能数字化的全新蜕变。
基于QbD理念的缓控释制剂开发
8 /16

质量源于设计( QbD)作为现代质量管理的基础理论之一,目前已逐步应用于药品研发、生产、流通和临床应用。相较传统的QbT理念,QbD将质量控制重心移至原料控制和制药过程控制,制订有针对性的策略,使产品质量始终介于可接受范围内,更加适用于药品生产,有利于药品质量的风险管理和持续改进。
2022年8月16日,博腾股份小分子事业部上海研发制剂经理张强先生以“基于QbD理念的缓控释制剂开发”为主题,通过微丸压片等产品开发实际案例和大家展开深入的探讨和交流。
张强先生强调,QbD在药品开发中的一般思路应该是,首先确定目标产品的质量概况,再确定对药品安全性、有效性和质量密切相关的属性。然后通过处方和工艺的风险评价,考察处方和工艺因素对产品iCQA和CQA的影响,建立设计空间以及相应的控制策略。从而确保所开发的处方工艺具有足够的耐用性,并能够在商业化批量条件下生产。

并在最后总结道药品开发采用QbD的方法的三大优势,其一在于其提升药品开发的成功率,然后是QbD可以令项目过程中积累的一些隐性知识显性化,显性知识结构化,最后则是可以确保药品在生产质量体系落地时,做到零偏差和零浪费。
药企GMP相关计算机化系统验证
及实例分享
10/19

企业进行计算机化系统验证除了出于法规部门对产品质量受控及数据完整性方面的要求,防患于未然确保系统的可靠性、保证良好的收益及符合良好的项目管理需求外,也可以从其危害角度来分析。
博腾股份集团质量部CSV高级经理薛勇先生就“药企GMP相关计算机化系统验证”作了直播分享,就“计算机化系统定义、为什么要进行计算机化系统验证、计算机化验证的流程”分别给出了答案。
其中关于“为什么要进行计算机化系统验证?”薛勇先生进行了重点介绍,其指出缺陷危害与数据完整性两点重点内容。前者对比设备缺陷,往往计算机化系统缺陷所给企业带来的后果严重性更高,企业在相关代价的付出上,计算机化系统灾难也远高于计算机化系统验证费用。至于数据完整性,制药行业作为一个强监管行业,计算机系统的验证不仅能确保系统的耐受性,帮助防止问题的出现;同时确保项目良好的手艺及良好的项目管理需要。
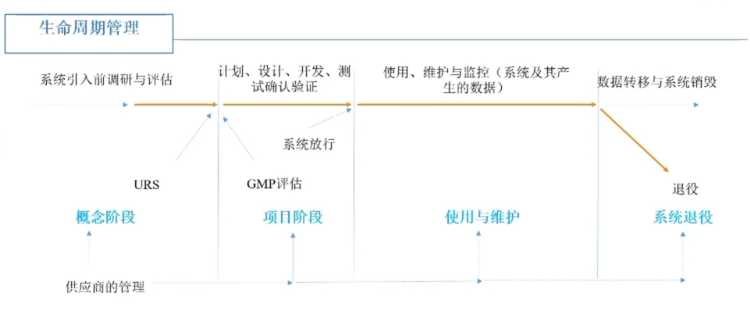
之后,在计算机化系统验证的具体流程上,薛勇先生还重点强调了计算机化系统全生命周期都需要基于风险进行风险管控的要点。 并从概念阶段、项目阶段、使用与维护、系统退役四部分全面、细致的进行了讲解。
最后总结道,计算机化系统验证是制药及相关行业质量保证中重要部分,科学合理的计算机化系统验证方法,才能确保制药及相关行业的各类智能化装备和信息化系统的持续可靠并符合法规要求。
福利彩蛋
划重点啦!感谢大家2022年的关注和陪伴,博药内容组为大家整理了博药直播间部分导师专属的PPT,识别下方二维码关注博药公众号,回复关键词「直播回顾」,经内部审批通过后,将有机会获取全年资料包,抓紧行动起来吧!


新年惊喜
本次活动还准备了其他惊喜,扫码关注博药微信公众号两种方式参与活动,精美礼品:U型枕、蓝牙音箱、超声波清洗机等你来领~

惊喜一:活动期间在博药微信号找到这篇文章并分享至朋友圈集赞满66个,设置所有人可见,截图发至博小腾助手企业微信兑奖,即可获得一份惊喜礼品![[礼物]](http://qmpres.oss-cn-hangzhou.aliyuncs.com/1672036265684285.gif)
![[加油]](http://qmpres.oss-cn-hangzhou.aliyuncs.com/1672036265684285.gif)
分享文案:博腾年度直播盘点,一“文”打尽,不能错过的“博药直播回顾”盘点,互动享年度惊喜礼品
惊喜二:互动有礼!选出2023年最值得你期待的博药直播课题:(多功能原料药车间领域、制药GMP 管理规范及管控、高端制剂开发、ai制药结合方向、药企信息化合规管理 ) 活动期间博小腾助手将选出8名幸运观众,获得年度惊喜礼品一份!
还有留言互动区的惊喜(PS:请看评论区第二条留言),限额8人哦,亲爱的博药用户抓紧啦!
活动说明
1.活动时间:2022年12月23日-2022年12月31日
2.资料发送时间:2023年1月10日前
3.活动结束后(2022年12月31日前),活动主办方会根据报名信息审核,活动期间请勿取关,获奖信息将由博药公众号直接推送
温馨提示
1. 如有疑问请联系活动客服博小腾助手

2.实物奖品兑换截止时间至2022年12月31日,逾期未兑换视为自动放弃
3.本活动最终解释权归博药运营团队所有




