【文章来源:博药(ID:PortonMKT)微信公众号。扫描或者识别下方二维码,即可关注博药,阅读更多行业深度与技术原创稿件,以及观看免费直播讲座~】

近年来,肿瘤细胞免疫治疗技术突飞猛进,其中 CAR-T 疗法发展最为成熟,已在血液肿瘤中展现出令人惊艳的疗效,为患者的治疗带来了新希望。
据弗罗斯特沙利文预计,全球CAR-T疗法市场空间将由2020年的10.8亿美元增长至2025年的90.5亿美元,年均增速高达53%。细胞治疗行业正在进入一个快速增长期。
然而,细胞治疗药物当前仍处于CMC发展初期,相关法规要求也随着科学、工艺技术以及对于细胞治疗药物全面认知的发展而变化,病人的个体差异也对生产工艺的稳定性和一致性以及质量的可控性形成挑战,因此CMC的复杂性和难度相对于其它生物药更大。根据FDA披露信息显示,细胞治疗多达80%发补与CMC相关,而传统药物的比例为20%。单一细胞治疗产品的BLA文件可达60000页,至少是典型传统生物制品的十倍。
如何把握细胞治疗CMC重难点,加快产品上市进展?博腾生物细胞治疗工艺开发助理副总经理胡迪超博士分享了他的经验~

胡迪超 博士
博腾生物细胞治疗工艺开发助理副总经理
一、可以介绍一下CAR-T的制备流程吗?
CAR-T技术是通过基因修饰技术将能特异性识别肿瘤特异性抗原的CAR分子结构导入人体T细胞,从而形成CAR-T细胞,其能够特异性识别肿瘤细胞,从而发挥高效杀伤肿瘤细胞而达到治疗的效果。
目前上市的CAR-T产品均为自体细胞细胞治疗药物,自体CAR-T制备主要包括以下步骤:
(1)单采血采集:首先需对患者采集单采血,此过程通常在医院端完成。
(2)PBMC分离:利用密度梯度离心的原理,使用自动化设备分离外周血单核细胞(PBMC)。
(3)T细胞富集(可选):使用CD4/CD8磁珠或CD3磁珠联合自动化分离设备富集CD3+T细胞。
(4)T细胞激活:使用CD3/CD28抗体或磁珠对静息状态的T细胞进行激活。
(5)T细胞修饰:利用基因修饰技术,通常使用慢病毒转导技术将携带CAR分子的基因序列投递至T细胞的基因组中,使其可持续表达CAR分子,并装配在T细胞表面,从而形成CAR-T细胞。
(6)CAR-T细胞扩增:为了获得足够量的用于QC放行检测以及治疗用的CAR-T细胞,需使用细胞培养扩增技术对CAR-T细胞进行扩增。
(7)CAR-T细胞收获和洗涤:细胞扩增到目标数量后,使用自动化收获设备收获CAR-T细胞,并利用离心洗涤原理去除CAR-T生产过程中加入的生产原材料以去除工艺相关杂质。
(8)CAR-T细胞制剂和冻存:使用开发的冻存液调整CAR-T细胞密度至所需的密度,按既定的分装体积分装冻存袋后使用梯度降温仪对CAR-T细胞进行冻存。
(9)CAR-T放行检测与回输:生产的CAR-T细胞经QC检测合格后就可以以冷链的方式运输到医院终端,并回输给患者发挥药物治疗作用。
CAR-T疗法示例
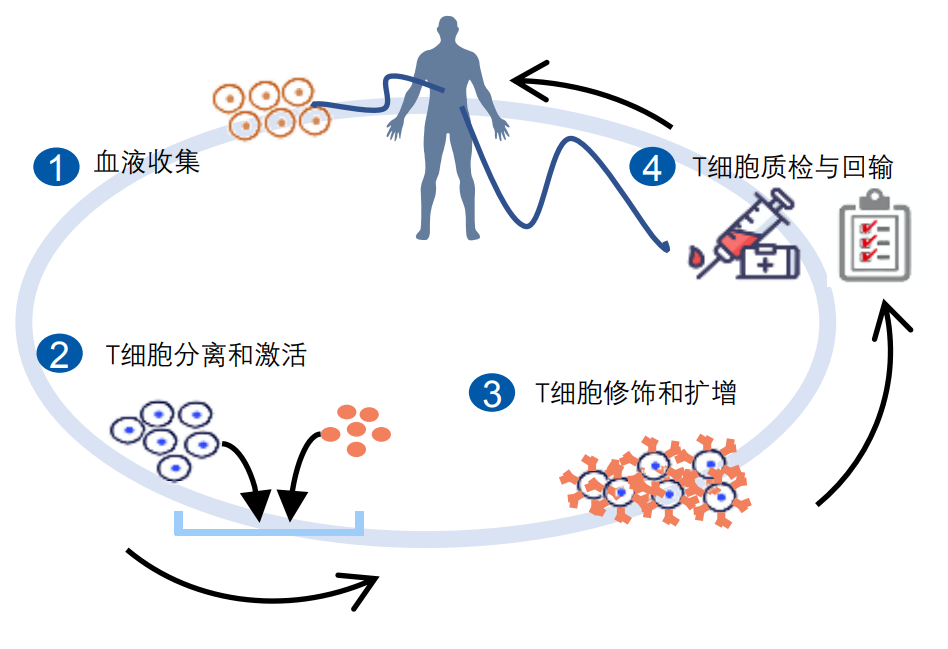
来源:沙利文分析
二、CAR-T产品工艺复杂,在CMC工程中,最大的难点是什么?如何应对?
CAR-T细胞治疗药物与普通创新药物在 CMC 环节有很大差异,难点主要体现在以下几方面:
一是,工艺的稳定性和一致性以及质量的可控性。CAR-T制备所用到的起始物料来源于donors血液中提取的T细胞。而目前已获批的CAR-T细胞药物均为自体CAR-T,donors为患者,个体间差异很大,从而导致CAR-T生产的起始物料差异很大,对CAR-T工艺的稳定性和一致性以及质量可控性带来很大挑战。而且在IND申报时,使用的是健康人donors,但在商业化阶段,使用的是病人donors,这也是对工艺的一个挑战。此外,CAR-T细胞通常使用γ-逆转录病毒载体或慢病毒载体进行T细胞转导,病毒载体批间的差异也会对工艺的稳定性和一致性形成挑战。
二是,成本问题。目前的CAR-T细胞药物可以说是“天价药物”,国外定价35-50万美元/剂,国内目前上市的两款CAR-T细胞药物价格也高达120万元/剂左右。高昂的治疗费用是影响药物可及性或者说可负担性的重要因素,因此如何降低生产成本是CAR-T产品面临的另一个挑战。目前来看,自体CAR-T降价空间仍然有限,但基于货架期的通用CAR-T细胞药物,即通用型CAR-T或异体CAR-T有很大潜力。目前通用型CAR-T尚无上市产品,但已有多个项目进入临床研究阶段。未来如果通用型CAR-T能顺利获批上市,或者在技术层面有其他突破,实现规模化生产,就有可能大幅降低成本。
当然,CAR-T产品CMC还面临很多其他挑战,比如说生物活性方法的开发和检测;快速放行检测等都还面临挑战。此外,通用型CAR-T还需要考虑基因编辑技术专利的问题,物料供应问题等等。
三、细胞治疗药物在中国与国际监管有何异同点?
首先从监管机构来看,目前国内外基本都实行双轨制,在细胞产品没有上市时,按照安慰用药或者研究者发起的临床研究(Investigator Initiated Trial,IIT)管理;在细胞产品作为成熟药品上市时,按照严格的生物制药法规和审批流程进行管理。
从产品的监管分类来看,美欧、日本将细胞治疗设为一个专门的类别来管理。例如,美国将细胞治疗药物归类为细胞、组织或基于细胞组织的产品管理;欧盟将细胞治疗药物归类为先进的治疗医学药品。在中国,目前将细胞治疗药物归类为生物制品,并没有单独设立一个类别。
从监管的专业程度来看,目前中国在监管架构上和国际上有一定差异。在中国,早期曾将细胞治疗作为一种医疗技术,由卫生医院系统进行监管,近几年才将细胞治疗产品划归为药品监督管理部门作为生物制品进行管理,而美国和欧洲为此额外地设立了细胞治疗药物的监管机构。
目前,细胞治疗药物技术革新较快,监管要求更新也很快,企业如何应对这种快速变化,才能让产品顺利获批?
首先,我们要对法规进行细致的解读,在细胞治疗药物的研发、生产过程中严格遵照国内外法规开展CMC活动。当然细胞治疗药物发展尚处于初期,法规也在不断进行调整,所以我们还要及时跟进新的法规、要求。
其次,企业一定要加强GMP的意识。因为细胞治疗产品的特殊性,它没有终端除菌过滤步骤,所以从厂房的设计、设备选型、工艺研究开发,到人员都要强化GMP意识。对于一个细胞治疗项目,需充分理解QbD的理念,开展充分的分子设计和成效性研究。
再次,合理的临床设计,适应症的选择,规范的临床试验,安全性和有效性数据详实也是获批的重要因素。
然后,对于细胞治疗的新技术,一定要与药监部门和相关专家保持充分沟通。现在很多做新技术的可能是science背景出身,但我们也要考虑到这种新技术应用到CMC阶段会不会有法规上的问题,所以对于新技术,一定要与相关的监管部门和专家保持沟通与讨论。
另外,企业可以考虑与CMO/CDMO公司的深度合作。因为细胞治疗产品在CMC方面比较复杂,涉及质粒、病毒、细胞等,CMO/CDMO公司有一个比较成熟的工艺生产和质量体系,而且实战经验比较丰富,所以biotech公司可以考虑与CMO/CDMO公司保持紧密的合作,这有助于项目顺利推进和申报成功。
四、未来细胞治疗药物还有哪些发展趋势?
CAR-T疗法作为近年来热点研发领域已为恶性血液肿瘤患者带来了希望,例如传奇生物的BCMA CAR-T疗法西达基奥仑赛(CARVYKTI®)的总缓解率ORR高达97.9%,疗效非常令人惊艳。
基于此,CAR-T疗法市场规模实现持续稳定增长,未来市场潜力巨大。据弗罗斯特沙利文预计,全球CAR-T疗法市场规模将由2020年的10.8亿美元增长至2025年的90.5亿美元,年均增速高达53%。
全球、美国及中国CAR-T疗法市场规模
(2017年、2020年及2025年(估计))
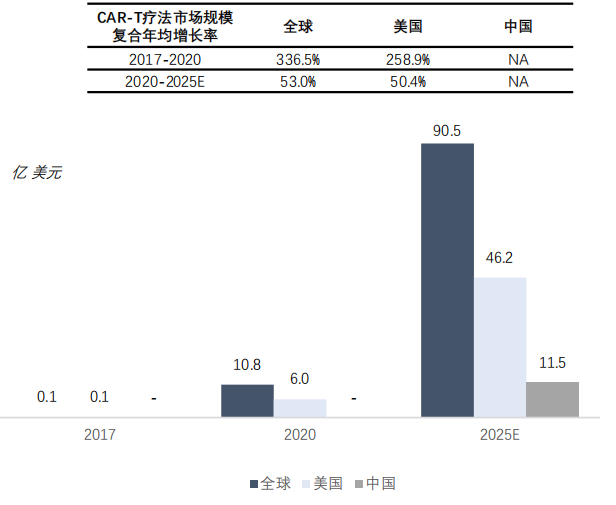
来源:沙利文分析
目前,国内已上市的两款CAR-T疗法产品,复星凯特的阿基仑赛(奕凯达)的药明巨诺的瑞基奥仑赛注射液(倍诺达),前者去年上市6个月销售额1亿元,后者上市3个月,已为药明巨诺贡献营收3079.7万元。而今年3月获美国FDA批准的传奇生物的Carvykti,首个完整上市季度就完成了2400万美元的销售额。可见市场潜力很大。
对于细胞疗法的发展趋势,从适应症来看,未来细胞疗法在实体瘤方面有望取得突破性进展。目前CAR-T疗法已在血液瘤方面取得不错成绩,而在实体瘤方面,目前尚无产品获批上市,不过从已披露的临床数据看来,已有产品展现出很好的治疗潜力。
从技术来看,通用型细胞疗法或者异体细胞疗法,包括UCAR-T、CAR-NK、以及基于iPSC的细胞治疗药等,对于降低生产成本,提高药物的可及性具有很大优势,未来可能会有比较大的突破。
此外,随着通用型细胞技术的发展,未来细胞生产规模也将得到大幅提升,而市场规模的增大,将进一步带动上下游供应链发展从而降低成本,从而实现细胞治疗药物的成本控制,最终提高药物的可及性。
至于降价空间,胡博认为不可预测,不过通用型细胞疗法未来从百万级降到十万级是很有可能的,将惠及更多患者。




