原料药质量是药品质量控制的关键和源头,其中,杂质研究是质量研究的关键点,也是难点之一。根据ICH Q3A(R2)指南,药品杂质分为无机杂质(inorganic impurities)、有机杂质(organic impurities) 和残留溶剂(residual solvents) 3类。
无机杂质主要是指原料药制备过程中加入的催化剂、无机盐、配体、试剂等;有机杂质主要是指起始物料、中间体、副产物等工艺杂质,以及药物在储存期间产生的降解产生的挥发性或者非挥发性的杂质;残留溶剂主要是原料药合成过程作为载体用于制备溶液或混悬液的液体。
在一定程度上,杂质控制水平反映了药物质量,那么压力就给到了原料药企业。如何在保证原料药质量的同时,有效控制杂质的含量呢?而且,随着新药开发的进程,杂质研究的深度和广度都在增加,又该如何应对?
5月26日,博腾股份小分子事业部分析研发总监蒋慧娟作了《原料药分析方法开发思路与案例分享》直播讲课,或许从中可以找到答案。
新药开发不同阶段分析方法的要求
分析方法是为完成各种检测项目而设定和建立的测试方法,是了解杂质信息的重要手段。根据ICH Q14草案,分析方法开发目的是在可报告范围内,以规定的专属性/选择性、准确度和/或精密度,对分析物的一项或多项属性进行测定。
《化学药物质量控制分析方法验证技术指导原则》(2005)中指出,分析方法通常包括:分析方法原理、仪器及仪器参数、试剂、系统适用性实验、供试品溶液制备、对照品溶液制备、测定、计算及测试结果的报告等。
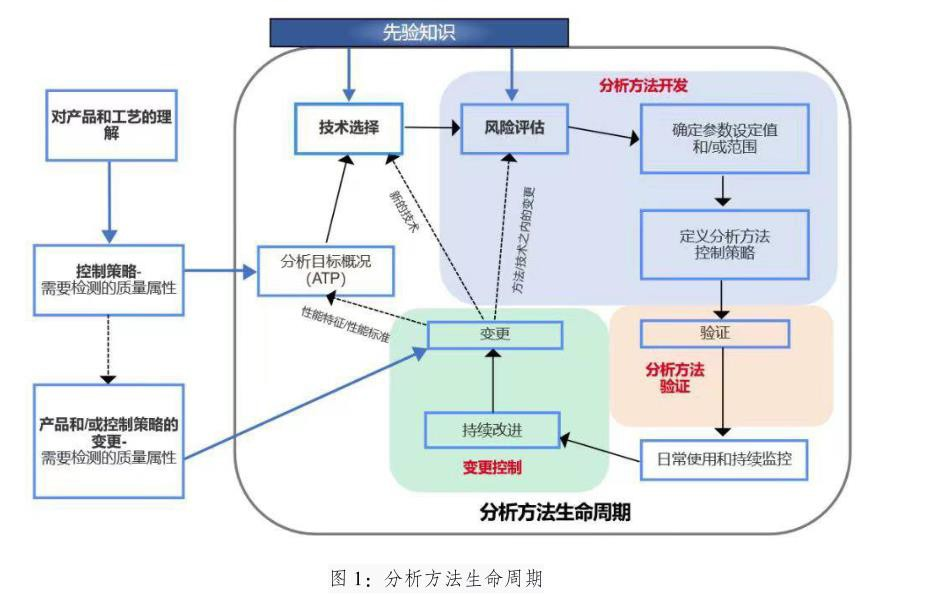
伴随新药开发的进程,原料药的生产工艺和参数不断变化,相应的分析方法也要改进,因此就要不断的进行方法开发和优化,以获得适用于预期目的的分析方法,由此开启了分析方法的生命周期闭环。
下图概述了药物开发不同阶段分析方法的要求。
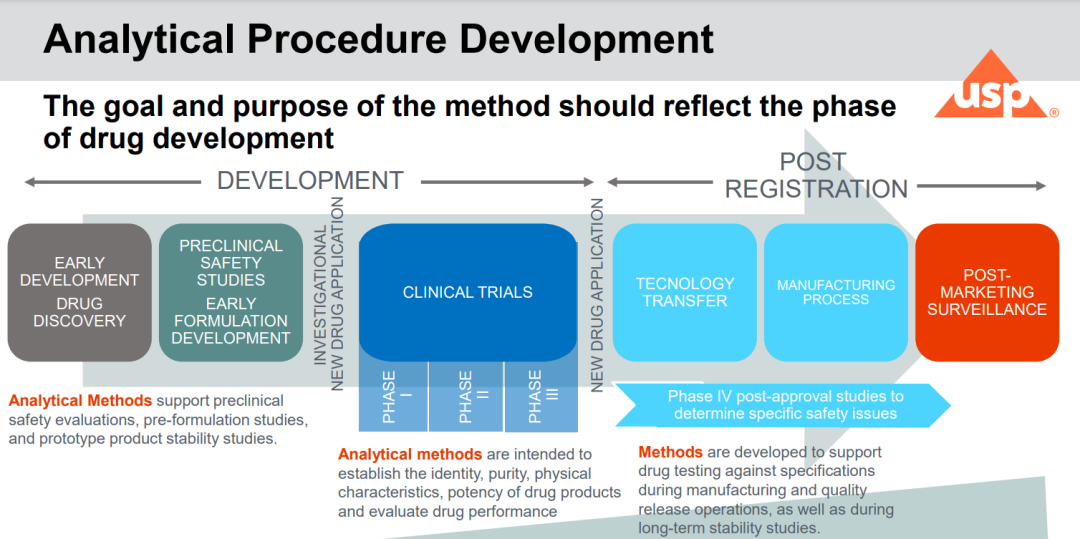
新药开发不同阶段分析方法的要求 图片来源USP
鉴于此前关于分析方法开发一直没有权威官方指南,因此CDE在药物开发不同阶段分析方法发布了区域性指导原则。比如在《化学药品创新药 I期临床试验申请药学共性问题相关技术要求》中关于质量标准和分析方法的一些共性问题:申报者仅简单提供质量标准,缺少提供部分关键项目的分析方法、未提供关键项目分析方法必要的验证信息。
对此CDE提出的一般性要求为:参照《新药 I 期临床试验申请技术指南》相关要求研究并制定临床试验样品质量标准,以表格形式提供相关检测项目和可接受限度要求。注意提供关键项目(例如有关物质、残留溶剂、金属催化剂及金属试剂残留、遗传毒性杂质、溶出度/释放度、含量等)的具体分析方法,以及必要的方法学确认信息(例如至少包括专属性、灵敏度等)。
《化学药品创新上市申请前会议药学共性问题及相关技术要求》关于原料药有关物质研究和控制也存在一定的问题:原料药杂质谱分析不充分;有关物质分析方法检出能力不足;杂质控制及限度制定依据不充分。
CDE提出的一般性要求为:参照 ICH Q3A 等相关指导原则进行杂质研究,全面分析杂质的来源,进行清除、转化研究,合理制定控制策略,提供完整的杂质谱研究信息和资料。
应对加速和长期试验中超过鉴定限的降解杂质进行归属研究,关注影响因素试验条件下降解杂质的研究,增强对降解途径的理解。如生产工艺发生变更,应分析研究可能产生的新杂质,考察有关物质方法的适用性。
有关物质分析方法应充分验证,合理选择杂质定量方法,例如,应评估外标法、加校正因子的自身对照法等定量方法,考虑杂质对照品制备的难易程度和持续提供情况,主成分作为对照的合理性等。
根据 ICH Q3A 等相关指导原则合理设定杂质限度,限度的制定需有动物安全性试验依据,必要时应重新进行动物安全性试验。
另外,我们值得补充的一点是,在ICH Q14填补了分析方法开发工具的空白。解析详情可直接查看《填补空白,ICH发布分析方法开发指南及验证指南》。
原料药分析方法开发流程
根据ICH Q14,对产品和工艺的理解(ICH Q8和ICH Q11“原料药开发和生产”),可识别出需要分析检测以进行控制的质量属性,这些属性的描述可见目标产品质量概况(QTPP),检测需求可记录在ATP(analytical target profile,分析目标文件)中,构成了分析方法开发的基础。
ATP包括对预期目的的描述、待测产品属性的详细信息以及相关性能特性与相关性能标准,它有助于技术选择、方法设计和开发以及后续性能监测和分析方法的持续改进。在整个生命周期内对ATP进行维护,也可将其用作生命周期管理的依据,以确保分析方法始终适用于预期用途。
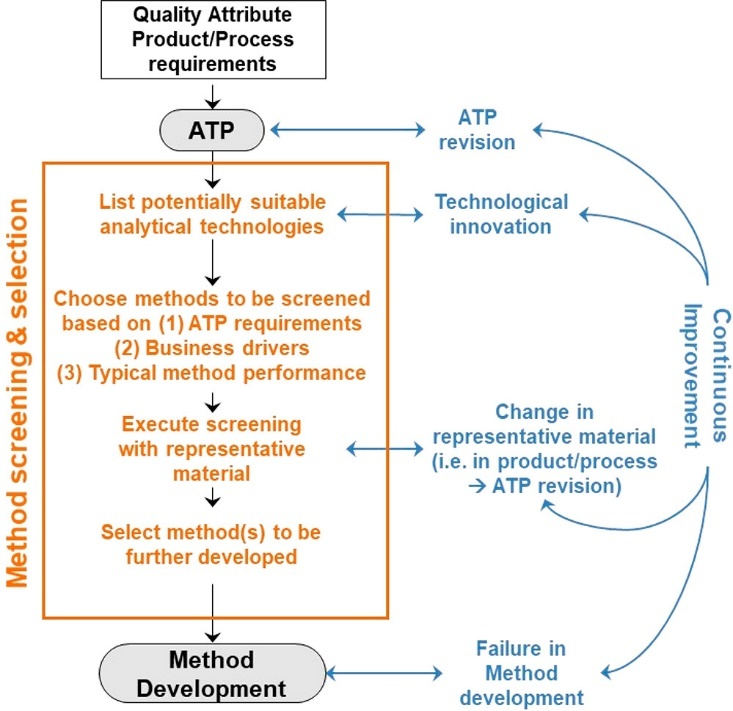
分析方法筛选和选择方法 图片来源:参考资料1
开发特定的分析方法开发过程需要关键步骤,首先要确定正在开发的方法类型,确定所开发的方法是用于检测还是纯度、残留溶剂或粒度等确定。并且还需要确定化合物的性质(活性药物成分、赋形剂等),以及选择技术。
对此,蒋总特对原料药分析开发中检测项目及其分析方法的实践作出了如下概述。
原料药分析方法开发概览表

表格来源:直播讲课PPT
分析方法被开发出来后,还需要对该方法进行优化,因为每种分析方法都必须适合其预期用途和阶段。完成优化之后,验证分析方法成为接下来的工作重点,这一步也是API成功的关键。本文重点分享博腾制药在有关物质通用分析方法开发的流程。该流程分为4步,首先完成样品准备和技术选择,然后进行方法筛选,之后再进行方法优化,最后对方法进行确认或预验证。
1. 样品准备和技术选择
博腾引入ACD/Labs 预测杂质及API的pKa, LogD等辅助方法开发。同时根据杂质谱情况,使用包含起始物料、中间体、反应副产物、降解杂质等的样品用于方法开发。另外粗品和强制降解样品也会考虑。
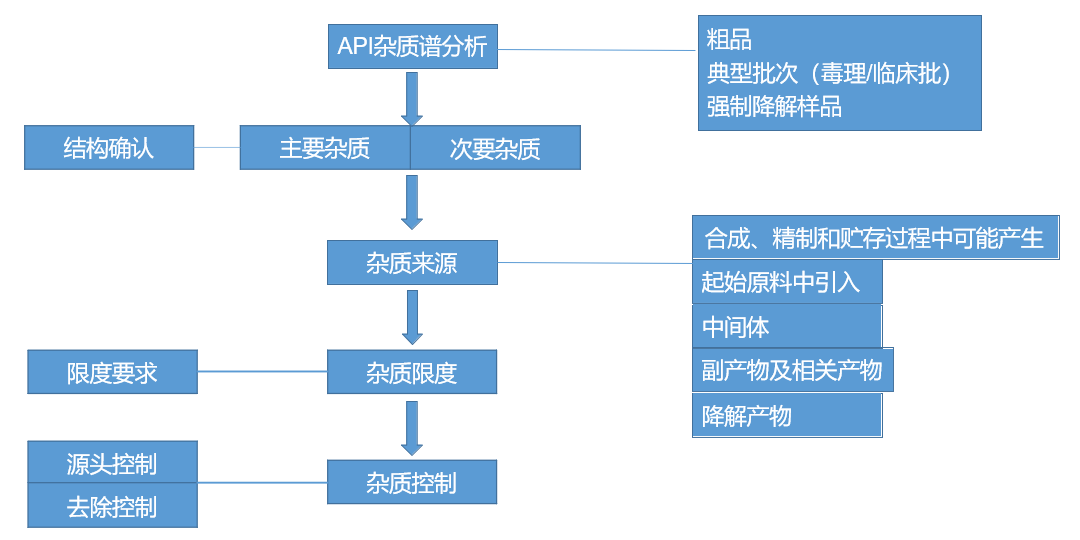
图片来源:直播讲课PPT截图
2. 方法筛选
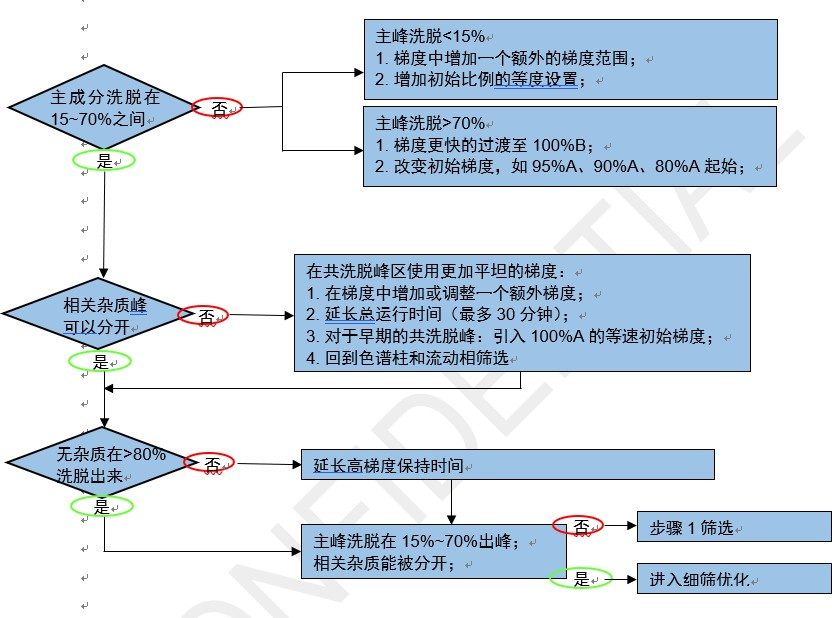
此步骤的主要目的是筛选不同的色谱柱、不同pH值的流动相和不同有机溶剂,根据检测能力及ACD/Labs辅助判断筛选结果。

图片来源:直播讲课PPT截图
3. 方法优化
初步筛选之后会进行进一步的方法优化,优化参数比如梯度、检测波长、流速、色谱柱、柱温、样品浓度、进样体积等。同时ACD/Labs 辅助单因素或多因素优化,初步确定最佳色谱条件,大大提高方法优化效率。
图片来源:直播讲课PPT截图
4. 方法确认/预验证
初步确定方法之后,需要对方法进行确认或预验证,具体项目包括专属性(包括强制降解实验),LOD&LOQ,方法耐用性等。若需要,再做方法优化,确定最终色谱条件。

图片来源:直播讲课PPT截图
以上流程完成后,会生成原料药有关物质开发的报告。
小 结
原料药分析方法开发是质量研究中的重点和难点,其需要非常丰富的专业知识,且各国药监管理局也一直在提高监管要求的标准。总的来说,分析方法开发是一项由多年经验、经验教训和战略思维磨练出来的技能,并以健全的科学流程为后盾。所以合适且有丰富经验的CDMO能帮助企业大大缩短从临床前到商业化的生命周期,为新药的开发保驾护航。
↓↓↓↓↓↓
PS:更多关于原料药分析方法开发问题探讨,欢迎添加博小腾入群交流~

[ 博小腾 ]
扫描或识别二维码
添加【博小腾】
入群深入沟通交流
参考资料:
[1] Selection of Analytical Technology and Development of Analytical Procedures Using the Analytical Target Profile. Analytical Chemistry 2022 94 (2), 559-570 DOI: 10.1021/acs.analchem.1c03854




