近日,中国肿瘤标志物学术大会肿瘤标志物临床转化产业发展论坛在云端召开,总经理赵辉博士受邀参加并做了《基于DNA甲基化超敏联检平台新型肿瘤标记物体系研发与应用》的主题分享。
我国肿瘤防控形势严峻
赵辉博士在报告中首先对我国肿瘤防控的形势作了简短介绍,癌症已经成为威胁公众健康的重大公共卫生问题,我国仅2020年一年新发病例数就高达457万例,平均每天确诊人数达1.25万例,2020年因癌症死亡人数高达300万例。我国的肿瘤防控形势已非常严峻,这给社会造成了巨大的经济负担,数字的背后也是一个个被毁掉的家庭。
在癌症的治疗端,早期发现,是治愈的关键。
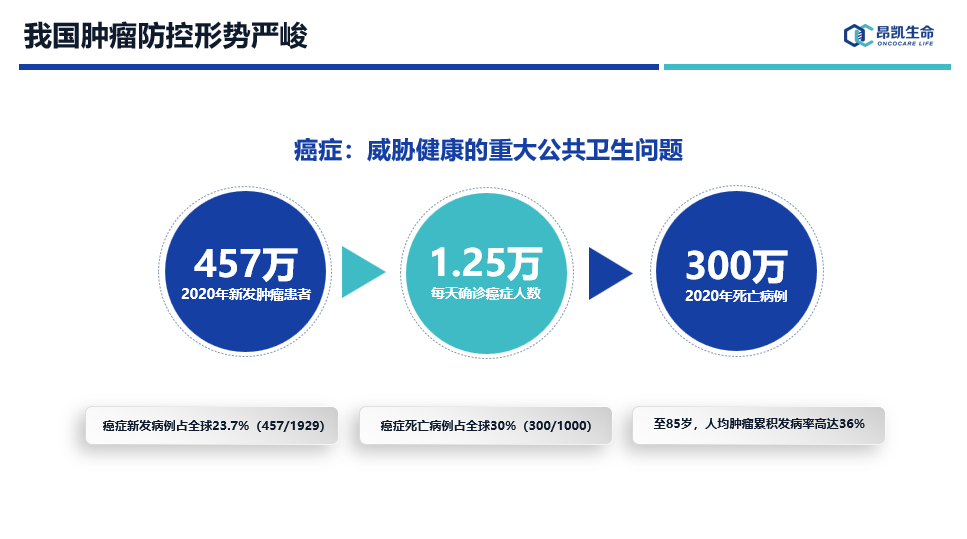
国外的经验早已证明,采取早期预防、早期筛查、早期治疗等防治措施,对于降低癌症的发病率和死亡率具有显著效果。
从左侧的统计图可以看到肿瘤Ⅰ/Ⅱ期患者生存期远远高于Ⅲ/Ⅳ期患者,像乳腺癌、肠癌等,如果早诊早治几乎是可以治愈的。在右图中我们可以看到,我国癌症患者5年总体生存率远低于欧美、日本等发达国家,这也反应我们整体肿瘤防控的问题,晚期发现率远高于发达国家近二三十个百分点。
液体活检对于肿瘤防控意义重大
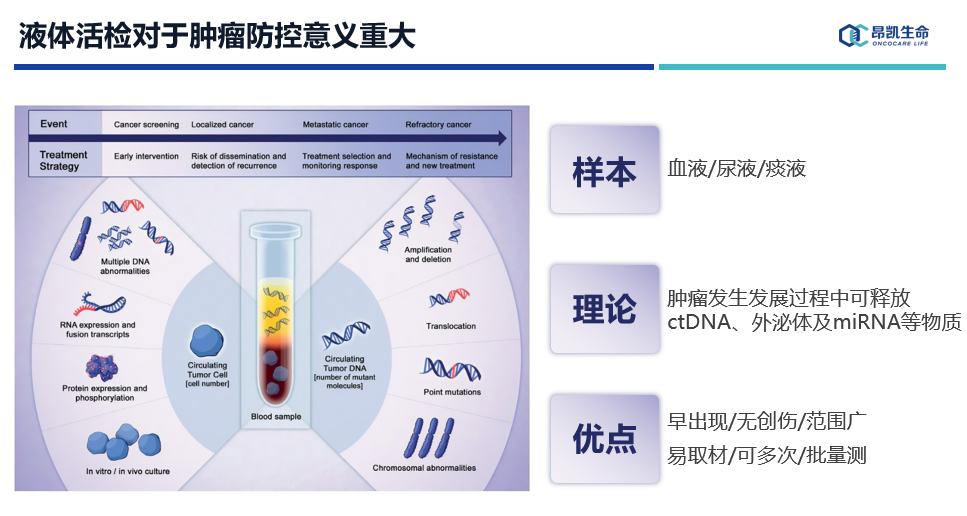
近年兴起的肿瘤液体活检技术可以说对于肿瘤防控意义非常大,肿瘤在进展过程中会释放或分泌肿瘤特有的信号,比如ctDNA、外泌体、miRNA等物质,一方面这些信号出现的相对比较早,另一方面液体活检具有取样方便、创伤小等优点,因此可以大大增加肿瘤机会性检出的概率,从这个角度来说,液体活检技术对于肿瘤防控意义重大。
美国肿瘤早检公司Grail利用五年的时间,花费了近20亿美元,通过多组学探索,最终证明DNA甲基化是肿瘤早检最佳标记物。
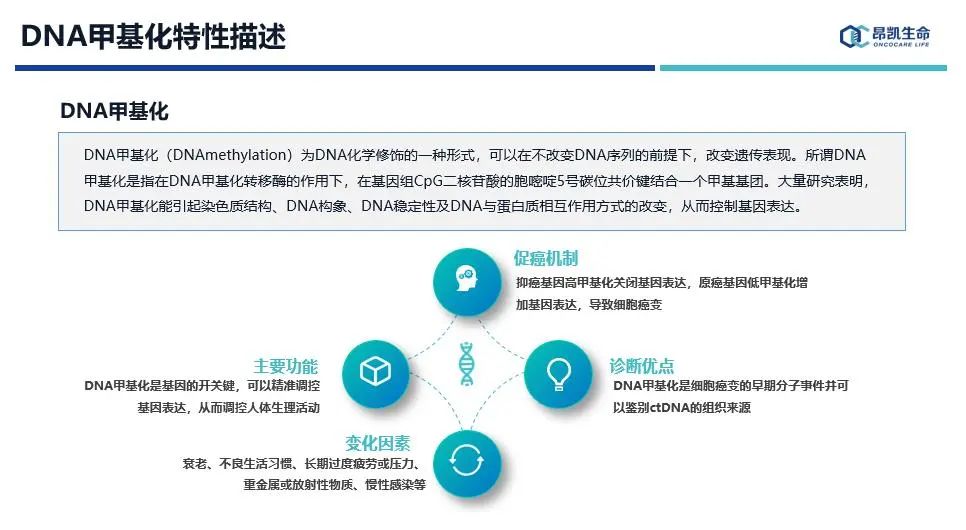
赵辉博士从主要功能、促癌机制、诊断优点、变化因素这四个方面对DNA甲基化的特性进行了介绍。
DNA甲基化检测面临的挑战
尽管DNA甲基化检测技术已发展到了一定阶段,但仍面临不少技术挑战。
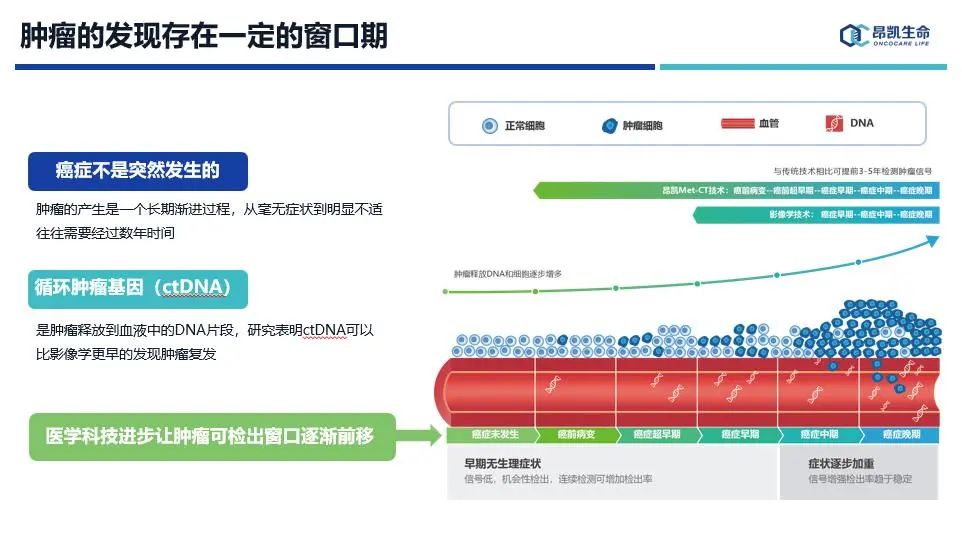
首先,肿瘤的发现存在一定的窗口期,而任何技术手段对于疾病检测都存在一定的窗口期,实践证明ctDNA检测技术要比传统影像学技术能更早的发现肿瘤信号,让肿瘤可检出窗口逐渐前移是医学进步的目标,因此早期发现肿瘤就是在追求检测极限,这本身就是非常具有挑战性的。
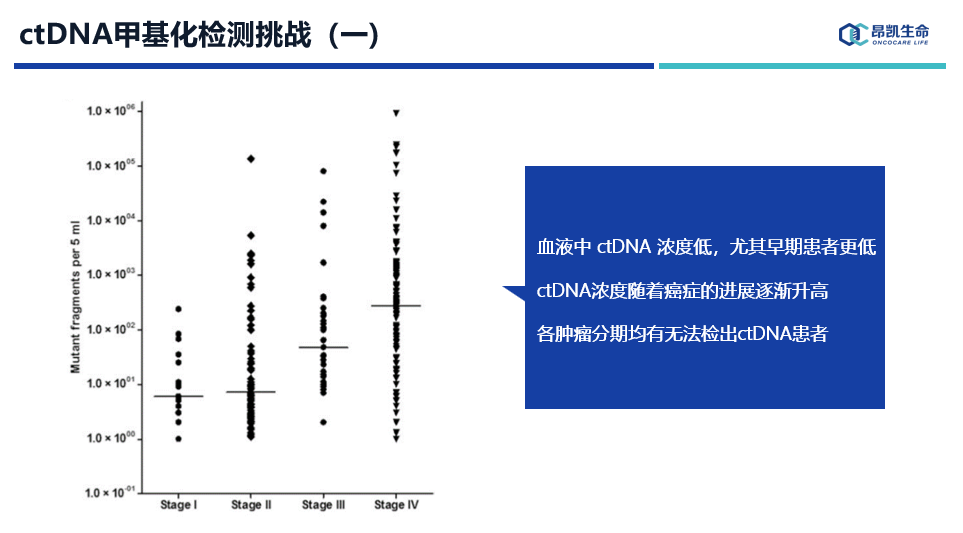
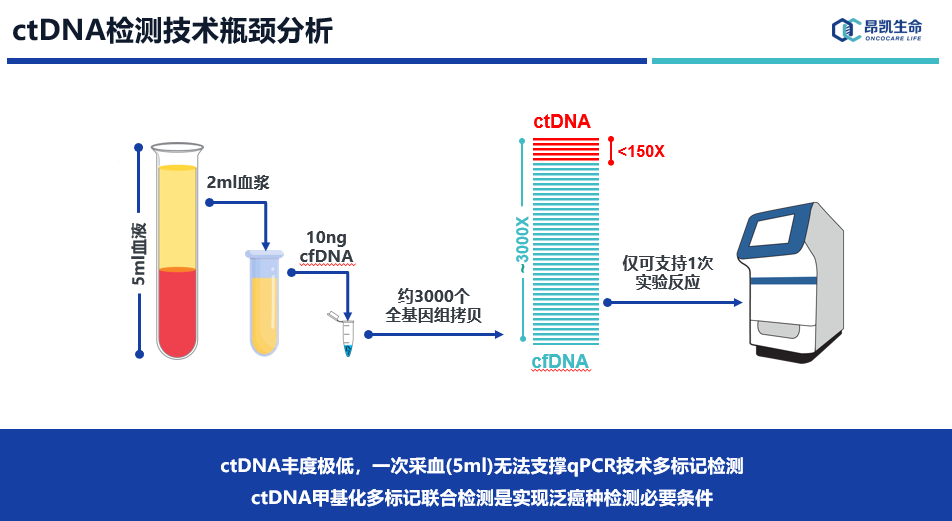
其次,血液中ctDNA浓度极低,每毫升血浆低至一个拷贝甚至没有ctDNA释放,我们可以观察到,随着肿瘤的分期进展ctDNA浓度逐渐升高,所以Ⅲ/Ⅳ期患者检出率会更高,这点也是和直观认知一致的。
此外,从每个分期数据单独来看,检测敏感性是存在天花板的,因为各肿瘤分期均有一定比例患者无法检出ctDNA信号,或者说这些患者根本就没有释放ctDNA入血,那么也就说释放ctDNA的人群比例就是ctDNA甲基化检测的极限。
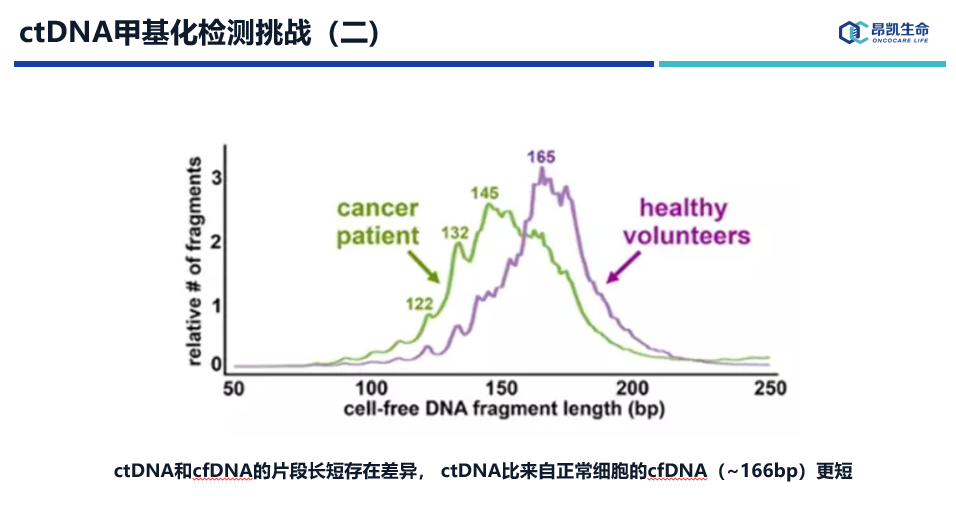
再者,ctDNA和cfDNA的片段长短存在差异, ctDNA比来自正常细胞的cfDNA(~166bp)更短,为(132~145bp)。这也就是说ctDNA碎片化程度更高,在加上实验过程中需要C到T的转化,目前主流方法是采用重亚硫酸盐方法,这将进一步损失DNA和降低DNA质量,增加检测难度。
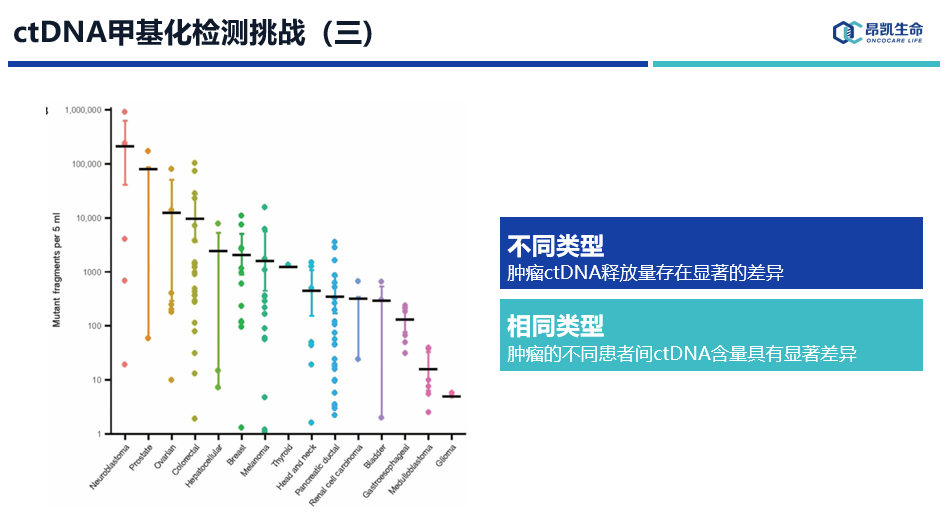
最后,不同类型肿瘤ctDNA释放量存在显著的差异,这直接导致相同的技术在不同癌型检出率存在很大的差异,而在相同肿瘤类型的不同患者之间ctDNA含量也具有很大的差异。
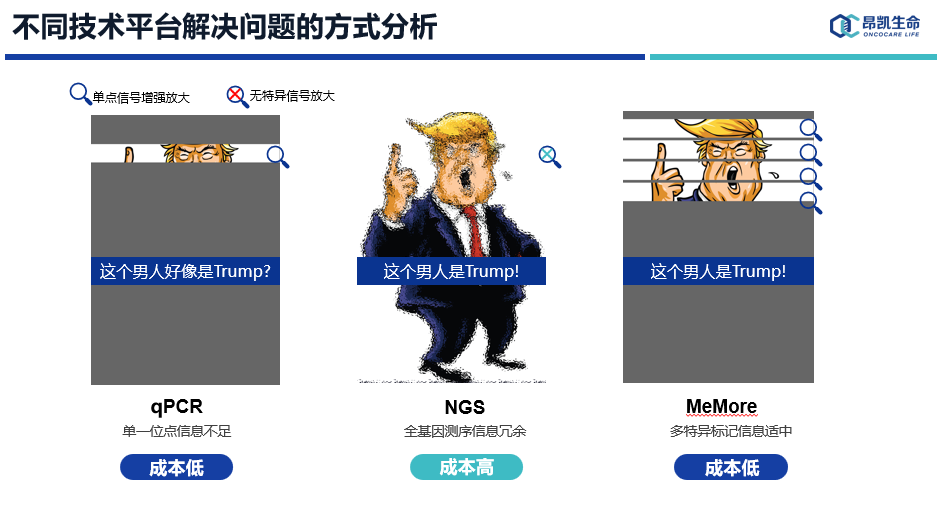
DNA甲基化检测技术平台有很多,但大部分技术受制于灵敏度不高,不适用于低起始量DNA检测,比如基因芯片技术,一代测序技术等。目前,应用于ctDNA甲基化检测产业化技术主要有两大平台:qPCR和NGS。
qPCR
ctDNA丰度极低,一次采血(5ml)无法支撑qPCR技术多标记检测。此外,虽然qPCR技术非常成熟,灵敏度甚至可以达2-3个拷贝,但同反应孔多基因检测难度非常大,限制了ctDNA甲基化在这个平台的临床应用。
NGS
NGS具有超高通量和发现或检测未知序列信息的能力,但NGS应用于DNA甲基化检测对痕量ctDNA定向富集也是有很大挑战的,此外还需要平衡检测成本、计算资源、计算时间等问题。

昂凯生命独家解决方案
ONCOCARE
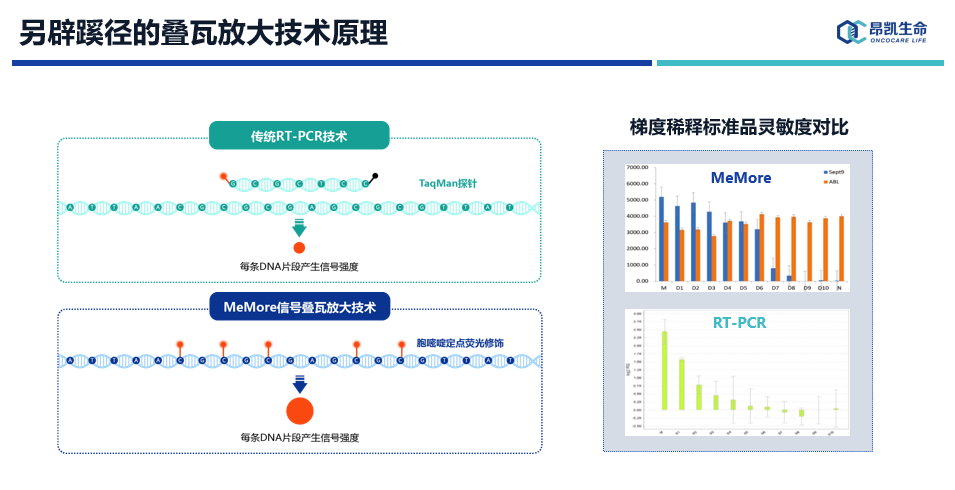
传统的PCR技术每一次分子扩增释放一个荧光信号,我们结合CpG甲基化特征提出了“叠瓦放大”原理,结合荧光微球,实现DNA甲基化超敏联检技术。MeMore技术叠瓦式把连续的CpG位点的C全部标记荧光信号,右图是我们连续三倍梯度稀释样本检测,MeMore技术检测极限在第6-7次之间,qPCR技术检测极限应该是在第4-5次之间,显示出MeMore技术极佳的检测性能。
昂凯生命自主研发的MeMore技术可以实现多个标记位点同反应孔,并且同步实现检测靶标,纵向和横向信号放大,可以显著的提升检测的敏感性和特异性,应该说MeMore技术在灵敏度、成本、通量、检测时间等方面都做了很好的平衡。